VACPERTAGEN
Laboratoire : BioNet Europe
Autorisation de mise sur le marché européenne (AMM) le 9 janvier 2026.
Le 13 novembre 2025, ce vaccin non combiné contre la coqueluche uniquement a reçu un avis favorable du Comité des médicaments à usage humain de l’Agence européenne des médicaments (EMA).
VACPERTAGEN est la dénomination européenne du vaccin PERTAGEN, déjà utilisé en Asie.
Ce vaccin pourrait modifier la stratégie vaccinale contre la coqueluche.
Description
Vaccin contre la coqueluche (recombinant, acellulaire, dose réduite, 2 composants, adsorbé).
Forme et Présentation
Suspension injectable en seringue préremplie.
Nature et contenu de l’emballage extérieur
- Suspension en dose unique (0,5 ml) dans une seringue préremplie (verre de type I) munie d’un piston (caoutchouc bromobutyle de type I) et d’une aiguille.
Conditionnement: une seringue préremplie.
Composition
Contenu dans une dose (0,5 mL).
1. Antigènes
Antigènes purifiés de Bordetella pertussis :
- Toxine coquelucheuse recombinante (PTgen)1,2 : 5 microgrammes
- Hémagglutinine filamenteuse (FHA)1 : 5 microgrammes
1 Adsorbée sur hydroxyde d’aluminium, hydratée 0,3 milligramme Al3+.
2 Produite dans Bordetella pertussis en tant que PT (pertussis toxine) génétiquement détoxifiée (PTgen) par la
technologie de l’ADN recombinant.
2. Autres composants
- Chlorure de sodium
Le formaldéhyde peut être présent à l’état de traces en tant que résidu du processus de fabrication
VacPertagen contient deux antigènes acellulaires majeurs de Bordetella pertussis : la toxine pertussique recombinante génétiquement détoxifiée (PTgen) et l’hémagglutinine filamenteuse (FHA).
Indications
VacPertagen est indiqué pour :
- l’immunisation de rappel contre la coqueluche chez les personnes âgées de 12 ans et plus,
- la protection passive contre la coqueluche au début de la vie par l’immunisation maternelle durant la grossesse.
L’utilisation de ce vaccin doit être conforme aux recommandations officielles.
Posologie
Personnes âgées de 12 ans et plus
Une dose unique de 0,5 ml doit être administrée.
Femmes enceintes
Une dose unique de 0,5 ml doit être administrée au cours du deuxième ou du troisième trimestre de grossesse (voir rubrique "Grossesse").
Population pédiatrique
La sécurité, l’immunogénicité et l’efficacité de VacPertagen chez les enfants âgés de moins de 12 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d'administration
VacPertagen ne doit être administré que par voie intramusculaire, de préférence dans le muscle deltoïde.
Ce vaccin ne doit pas être administré par voie intravasculaire, intradermique ou sous-cutanée.
Le contenu de la seringue préremplie VacPertagen doit être bien agité avant utilisation. Si la remise en suspension ne se produit pas après une agitation vigoureuse ou si des particules étrangères ou une décoloration sont observées, le vaccin ne doit pas être utilisé.
Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique "Composition" ou au formaldéhyde. Hypersensibilité après une précédente administration de VacPertagen ou de tout autre vaccin contre la coqueluche.
La vaccination par ce vaccin est contre-indiquée si une personne a déjà présenté par le passé une réaction allergique sévère ou toute encéphalopathie d’étiologie inconnue dans les 7 jours suivant une vaccination antérieure par un vaccin contenant la coqueluche.
Le vaccin contre la coqueluche ne doit pas être administré aux personnes présentant des troubles neurologiques ou une épilepsie non contrôlée tant que le traitement de l’affection n’a pas été mis en place, que l’état n’est pas stabilisé et que le bénéfice de la vaccination ne l’emporte pas clairement sur le risque.
Mises en garde et précautions d'emploi
Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Avant l’immunisation
La vaccination doit être précédée d’un examen des antécédents médicaux, en particulier des effets indésirables survenus après les vaccinations antérieures.
Vaccin contenant la coqueluche
Si l’un des événements suivants s’est produit après l’administration d’un vaccin contenant la coqueluche, la décision d’administrer d’autres doses d’un vaccin contenant la coqueluche doit être soigneusement examinée :
- Température ≥ 40 °C dans les 48 heures, non imputable à une autre cause identifiable
- Effondrement ou état de choc (épisode d’hypotonie-hyporéactivité [HHE]) dans les 48 heures suivant la vaccination
- Pleurs persistants pendant ≥ 3 heures, survenant dans les 48 heures suivant la vaccination
- Convulsions avec ou sans fièvre, survenant dans les 3 jours suivant la vaccination.
Dans certaines circonstances, comme une forte incidence de la coqueluche, les bénéfices potentiels peuvent l’emporter sur les risques possibles.
Hypersensibilité et anaphylaxie
Comme pour tous les vaccins injectables, des soins médicaux appropriés doivent être facilement accessibles en cas de réaction anaphylactique après l’administration du vaccin.
Réactions liées à l’anxiété
Des réactions liées à l’anxiété, y compris des réactions vasovagales (syncope), une hyperventilation ou des réactions liées au stress, peuvent survenir en association avec la vaccination en tant que réponse psychogène à l’injection par aiguille. Il est important de prendre des précautions afin d’éviter tout risque de blessure lié à un évanouissement.
Pathologie concomitante
La vaccination doit être différée chez les personnes souffrant d’une maladie fébrile aiguë sévère ou d’une infection aiguë. La présence d’une infection mineure et/ou d’une fièvre de faible intensité ne doit pas retarder la vaccination.
Thrombocytopénie et troubles de la coagulation
Comme pour les autres injections intramusculaires, le vaccin doit être administré avec prudence chez les personnes recevant un traitement anticoagulant ou souffrant de thrombocytopénie ou de tout trouble de la coagulation (tel que l’hémophilie). Des saignements ou des ecchymoses peuvent survenir après une injection intramusculaire chez ces personnes.
Personnes immunodéprimées
Il n’existe pas de données cliniques concernant VacPertagen chez les personnes immunodéprimées. L’immunogénicité du vaccin peut être réduite par un traitement immunosuppresseur ou une immunodéficience. Il est recommandé de reporter la vaccination jusqu’à la fin de ce traitement ou de cette maladie. Néanmoins, la vaccination des personnes présentant une immunodéficience chronique, telle qu’une infection par le VIH, est recommandée, même si la réponse en anticorps peut être réduite.
Limites de l’efficacité du vaccin
Comme c’est le cas pour tout vaccin, il se peut qu’une réponse immunitaire protectrice ne soit pas obtenue chez tous les vaccinés.
Réponse immunitaire des nourrissons après vaccination maternelle
Des données limitées indiquent que les anticorps maternels interfèrent avec l’induction d’une réponse immunitaire spécifique à la toxine coquelucheuse (PT) lors de la primovaccination par le vaccin DTwP/DTaP chez les nourrissons nés de femmes vaccinées avec VacPertagen pendant la grossesse (voir les rubriques "Pharmacodynamie").
Excipient à effet notoire
VacPertagen contient moins de 1 mmol de sodium (1,7 mg) par dose, c’est-à-dire qu’il est essentiellement «sans sodium».
Interactions
Aucune étude d’interaction n’a été réalisée. L’administration concomitante de VacPertagen et d’autres vaccins n’a pas été étudiée.
Fertilité
Aucune donnée n’est disponible sur la fertilité humaine. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la fertilité des femelles (voir la rubrique "Autres informations / Données de sécurité préclinique ").
Grossesse
VacPertagen peut être administré au cours du deuxième ou du troisième trimestre de la grossesse, conformément aux recommandations officielles (voir la rubrique "Posologie").
Les données de sécurité issues de trois essais cliniques randomisés contrôlés (250 grossesses), d’un essai observationnel prospectif (497 grossesses), de deux essais observationnels rétrospectifs (2 565 grossesses) et d’une surveillance passive dans le cadre desquels VacPertagen ou Td-VacPertagen (tétanos, diphtérie et VacPertagen) ont été administrés à des femmes enceintes au cours du deuxième ou du troisième trimestre, n’ont montré aucun effet indésirable lié au vaccin sur la grossesse ou sur la santé du fœtus ou du nouveau-né.
Il n’existe pas de données sur l’utilisation de VacPertagen chez la femme enceinte au cours du premier trimestre de la grossesse. Par mesure de précaution, il est préférable d’éviter l’utilisation de VacPertagen au cours du premier trimestre de la grossesse.
Voir la rubrique "Mises en garde et précautions d'emploi" pour les conséquences possibles de la vaccination pendant la grossesse sur la primovaccination infantile.
Les études chez l’animal n’ont pas montré de toxicité sur la reproduction (voir la rubrique "Autres informations / Données de sécurité préclinique ").
La vaccination de la femme enceinte permet d'immuniser le nouveau-né.
Les anticorps maternels sont transférés aux nourrissons nés de femmes vaccinées au cours du deuxième ou du troisième trimestre de grossesse.
Allaitement
Aucune étude sur l’allaitement n’a été réalisée. Il n’existe pas de données sur l’excrétion de VacPertagen dans le lait maternel. Étant donné que ce vaccin contient des antigènes inactivés, aucun risque n’est attendu chez le nourrisson. Une évaluation des bénéfices et des risques doit être effectuée avant toute décision de vaccination d’une femme allaitante.
Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés après la vaccination par VacPertagen étaient les suivants: douleur au site d’injection (77,6 %), maux de tête (59,7 %), fatigue (52,2 %), myalgie (45,3 %), arthralgie (24 %), malaise (22,7 %) et nausées (22,4 %). La majorité des réactions étaient d’intensité légère et ont disparu au bout de quelques jours après leur apparition.
Tableau des effets indésirables
La sécurité d’une dose unique de VacPertagen a été évaluée chez 2 508 personnes âgées de 12 ans et plus, dont 150 adolescents, 2 318 adultes non enceintes et 40 femmes enceintes, sur la base des données issues d’essais cliniques randomisés contrôlés (tableau 1).
Les effets indésirables sont répertoriés selon les catégories de fréquence suivantes :
- très fréquent (≥ 1/10);
- fréquent (≥ 1/100 à < 1/10);
- peu fréquent (≥ 1/1 000 à < 1/100);
- rare (≥ 1/10 000 à < 1/1 000);
- très rare (< 1/10 000);
Les effets indésirables signalés sont répertoriés par classe de système d’organes. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
Affections hématologiques et du système lymphatique
- Fréquent : lymphadénite, lymphadénopathie.
Affections du système nerveux
- Très fréquent : céphalées.
Affections cardiaques
- Rare : palpitations.
Troubles gastro-intestinaux
- Très fréquent : nausées.
- Fréquent : vomissements, diarrhées, entérite.
Affections de la peau et du tissu sous-cutané
- Fréquent : éruption cutanée, urticaire.
Affections musculosquelettiques et du tissu conjonctif
- Très fréquent : myalgie, arthralgie.
Troubles généraux et anomalies au site d’administration
- Très fréquent : douleur au site d’injection, fatigue, malaise.
- Fréquent : prurit au site d’injection, induration au site d’injection, hématome au site d’injection, frissons, fièvre.
- Peu fréquent : érythème au site d’injection, gonflement au site d’injection.
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
VacPertagen n’a aucun effet, ou a un effet négligeable, sur l’aptitude à conduire des véhicules et à utiliser des machines. Toutefois, les personnes doivent éviter de conduire ou d’utiliser des machines si elles présentent des symptômes susceptibles d’altérer leur capacité à se concentrer ou à réagir, tels que de la fatigue ou une myalgie.
Surdosage
Un surdosage de VacPertagen est peu probable en raison de sa présentation en dose unique. Il n’existe pas de traitement spécifique en cas de surdosage par VacPertagen. En cas de surdosage, la personne doit faire l’objet d’une surveillance et recevoir un traitement symptomatique approprié.
Pharmacodynamie
Classe pharmacothérapeutique : Vaccins, vaccins bactériens, vaccins contre la coqueluche?
Cde ATC : J07AJ02.
Mécanisme d’action
VacPertagen contient deux antigènes coquelucheux purifiés: la toxine coquelucheuse recombinante (PTgen) et l’hémagglutinine filamenteuse (FHA). Après une administration intramusculaire, VacPertagen induit une augmentation des réponses en anticorps spécifiques à la PT et à la FHA. Les anticorps maternels sont transférés aux nourrissons nés de femmes vaccinées au cours du deuxième ou du troisième trimestre de grossesse.
Immunogénicité
Les données d’efficacité ne sont pas disponibles pour VacPertagen. Aucun corrélat de protection n’a été établi pour la coqueluche.
L’efficacité de VacPertagen a été extrapolée en comparant les taux d’anticorps spécifiques aux 2 antigènes coquelucheux contenus dans VacPertagen avec ceux induits par des vaccins contenant 3 ou 5 antigènes coquelucheux.
L’immunogénicité a été évaluée par rapport à la moyenne géométrique des concentrations (MGC) des IgG-PT et IgG-FHA, mesurée par un test immuno-enzymatique (ELISA), et de l’anticorps neutralisant la PT (PTNA) mesuré par un test sur cellules ovariennes de hamster chinois (CHO).
Réponse immunitaire chez les adolescents et les adultes
L’immunogénicité de VacPertagen a été évaluée dans deux essais randomisés contrôlés incluant 148 adolescents (TDA202) et 75 adultes âgés de 18 ans et plus (TDA206).
L’essai TDA202 est un essai de phase III, bicentrique, randomisé contrôlé, avec observateur en aveugle, réalisé chez des adolescents en bonne santé, non enceintes, âgés de 12 à 17 ans (âge moyen de 14 ans). Au total, 450 personnes ont été randomisées selon un ratio 1:1:1 pour recevoir VacPertagen, dT-VacPertagen ou le comparateur dTap. La majorité des participants étaient de sexe féminin (58 %) et d’origine asiatique (100 %).
L’essai TDA206 est un essai clinique de phase III, monocentrique, , randomisé, avec observateur en aveugle, et contrôlé par un comparateur actif, réalisé chez des adultes en bonne santé, non enceintes, âgés de 18 à 75 ans (âge moyen de 44 ans). Au total, 750 personnes ont été randomisées selon un ratio de 1:1:1:1:1 pour recevoir différentes formulations de vaccins acellulaires contre la coqueluche (y compris VacPertagen) ou un comparateur dTap. La randomisation a été stratifiée par groupe d’âge. Chaque groupe comprenait 120 participants âgés de 18 à 64 ans et 30 participants âgés de 65 à 75 ans.
La réponse immunitaire après vaccination avec VacPertagen chez les adolescents et les adultes est
présentée dans le tableau 1.
Tableau 1 - MGC des anticorps anti-coquelucheux observés avant et 28 jours après une dose de VacPertagen.
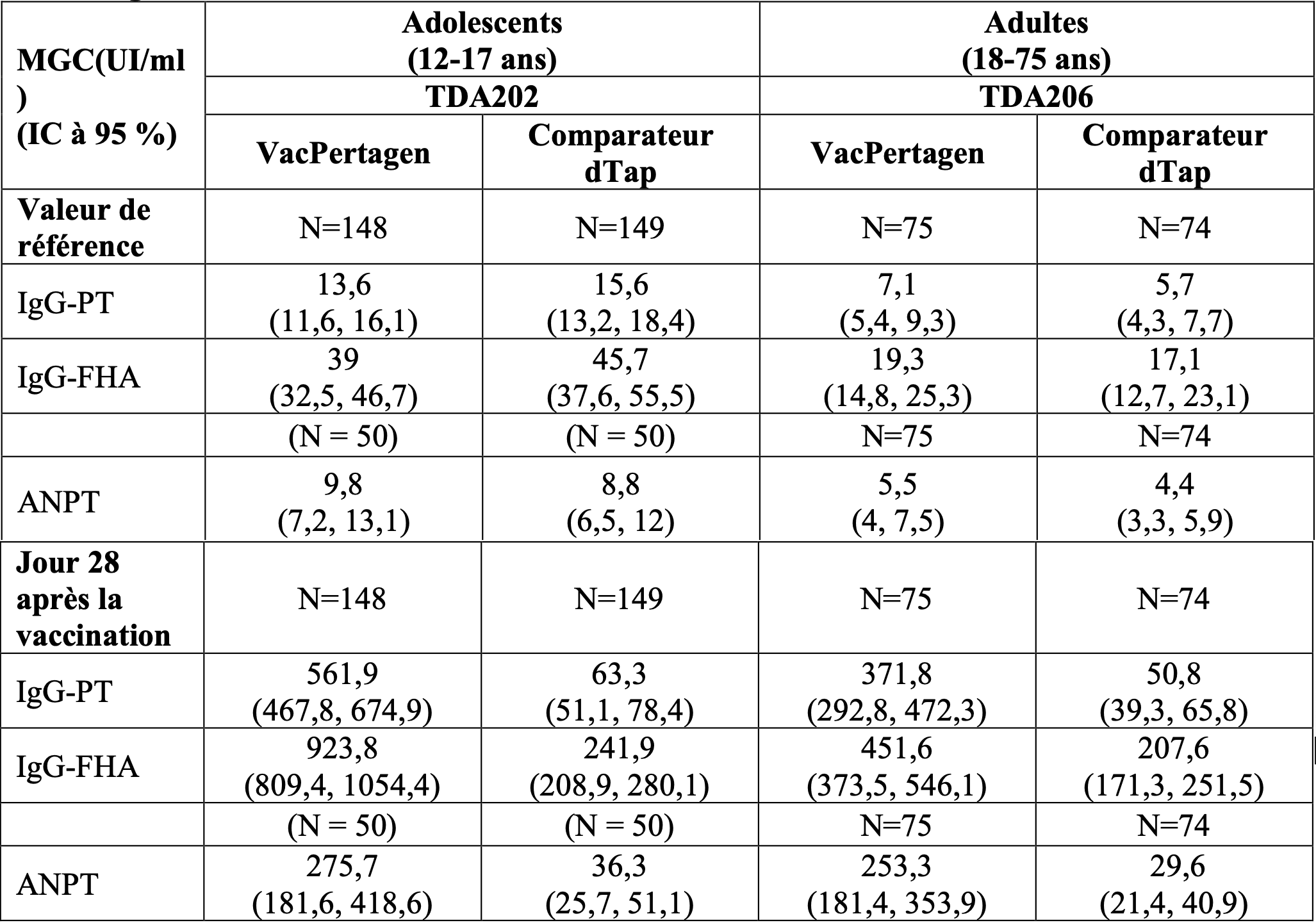
La persistance des anticorps, basée sur les mcg, a été évaluée chez les adolescents et les adultes, respectivement jusqu’à 5 et 3 ans après la vaccination par VacPertagen (tableau 2).
Tableau 2 - Persistance des anticorps (MGC).
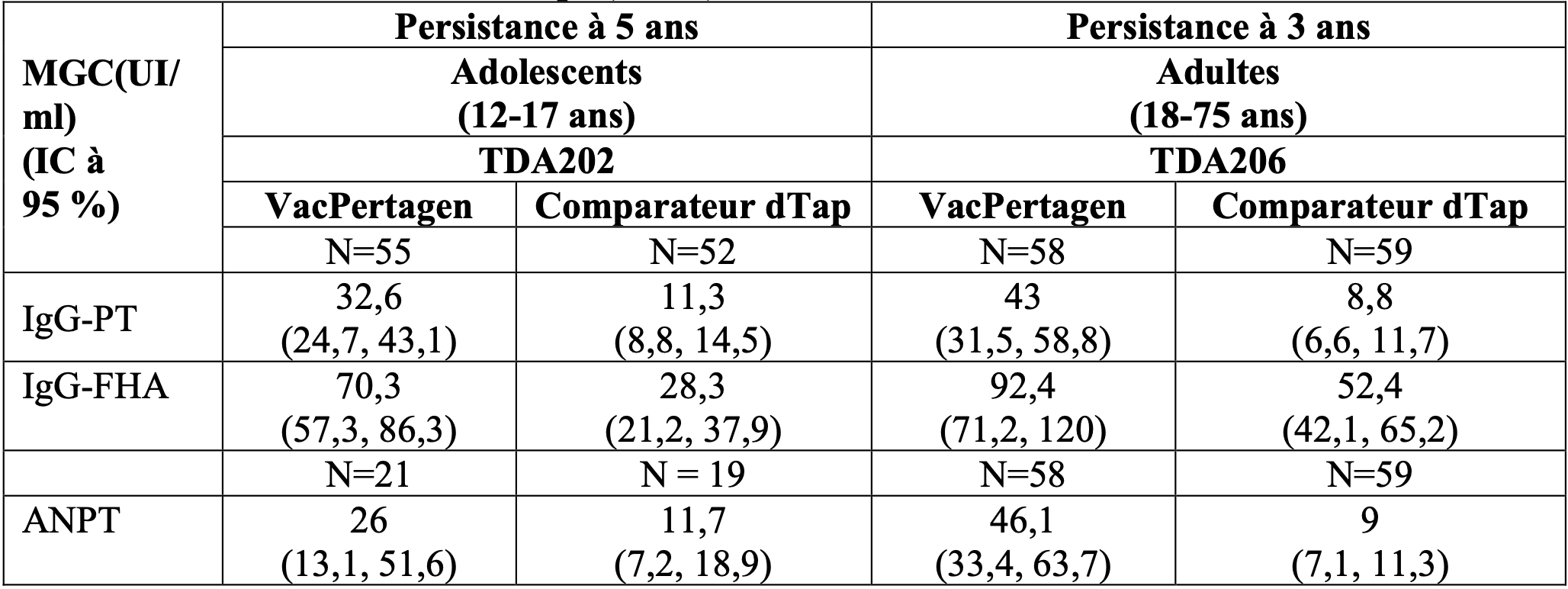
L’essai TDA207 est un essai vaccinal de phase II, bicentrique, observateur en ouvert, randomisé et contrôlé par un comparateur actif réalisé chez des femmes enceintes en bonne santé, primovaccinées avec un vaccin à germe entier contre la coqueluche, âgées de 18 à 40 ans (âge moyen de 29,8 ans). Au total, 240 femmes enceintes ayant une grossesse unique non compliquée ont été randomisées de manière égale (1:1:1:1:1:1) afin de recevoir différentes formulations de vaccins acellulaires contre la coqueluche (y compris VacPertagen) ou un vaccin comparateur dTap au cours du deuxième ou du troisième trimestre (semaines de gestation 20 à 33).
La réponse anticorps contre la coqueluche chez les femmes enceintes vaccinées avec VacPertagen est présentée dans le tableau 3.
Tableau 3 - Réponse immunitaire contre la coqueluche chez les femmes enceintes avant et 28 jours après la vaccination par VacPertagen.
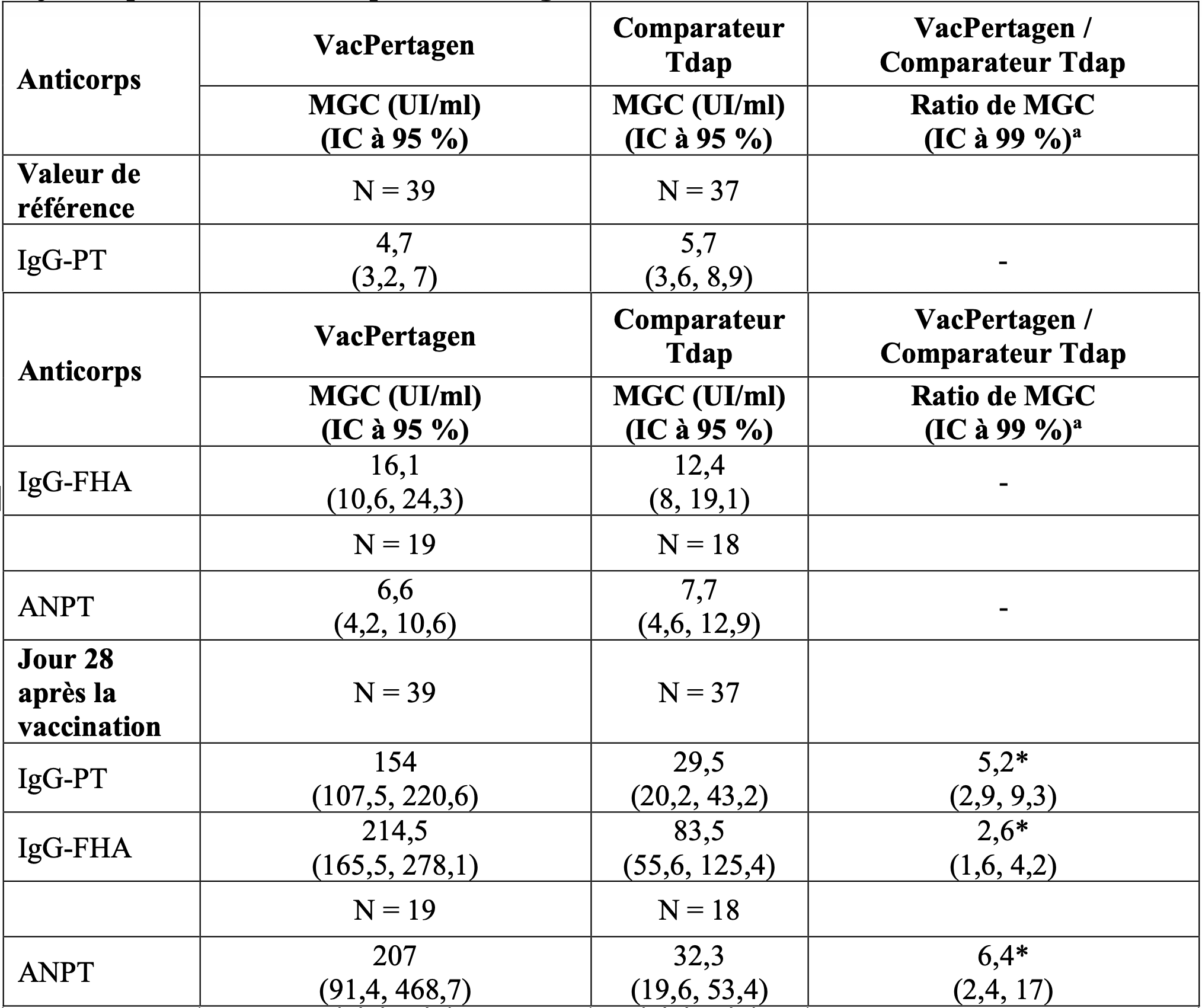
* Les MGC des anticorps IgG anti-PT, IgG anti-FHA et ANPT induits par VacPertagen étaient significativement plus élevés que ceux du vaccin comparateur (p < 0,05).
Immunogénicité chez les nourrissons (< 2 mois) nés de femmes vaccinées avec VacPertagen pendant la grossesse.
Dans l’essai TDA207, les anticorps anti-coquelucheux ont été transférés des mères aux nourrissons avec un ratio de transfert transplacentaire similaire chez les nourrissons nés de femmes vaccinées avec VacPertagen ou avec le comparateur dTca. Les concentrations en anticorps anti-coquelucheux chez les nourrissons à la naissance et à l’âge de 2 mois (avant la primovaccination infantile) sont présentées dans le tableau 4.
Tableau 4 - Anticorps anti-coquelucheux contre la coqueluche transférés passivement chez les nourrissons avant la primovaccination.
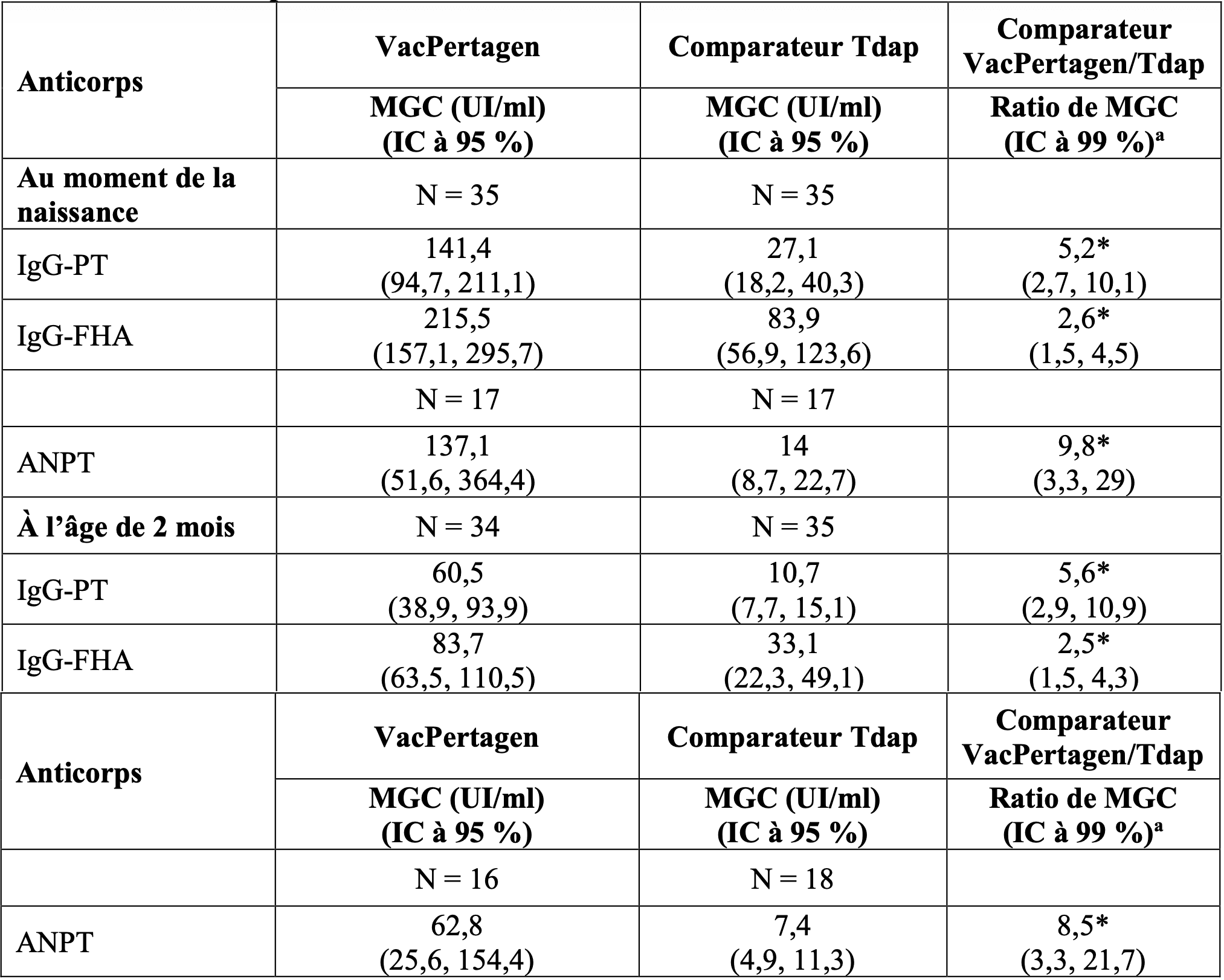
a Le ratio de MGC entre les groupes vaccinaux a été calculé avec un IC à 99 % sur la base du niveau de signification ajusté par la méthode de Bonferroni (0,05) pour l’analyse post-hoc.
* Différence significative avec une valeur p < 0,05.
Immunogénicité chez les nourrissons nés de femmes vaccinées avec VacPertagen pendant la grossesse.
Dans l’essai TDA207, les nourrissons ont été vaccinés avec trois doses de vaccins contre la coqueluche (DTPw ou DTCa). La plupart des nourrissons nés de mères vaccinées avec VacPertagen (n=29/35) ou avec le vaccin comparateur (n=23/32) ont reçu un vaccin contre la coqueluche à germe entier (DTwP), à l’âge de 2, 4 et 6 mois. La concentration en anticorps anti-coquelucheux chez les nourrissons âgés de 7 mois était plus faible pour les IgG-PT dans le groupe VacPertagen (tableau 5). Étant donné qu’aucun corrélat de protection pour la coqueluche n’a été établi, la pertinence clinique de ces observations reste établir.
Tableau 5 - Réponse immunitaire contre la coqueluche chez les nourrissons avant et après la primovaccination.
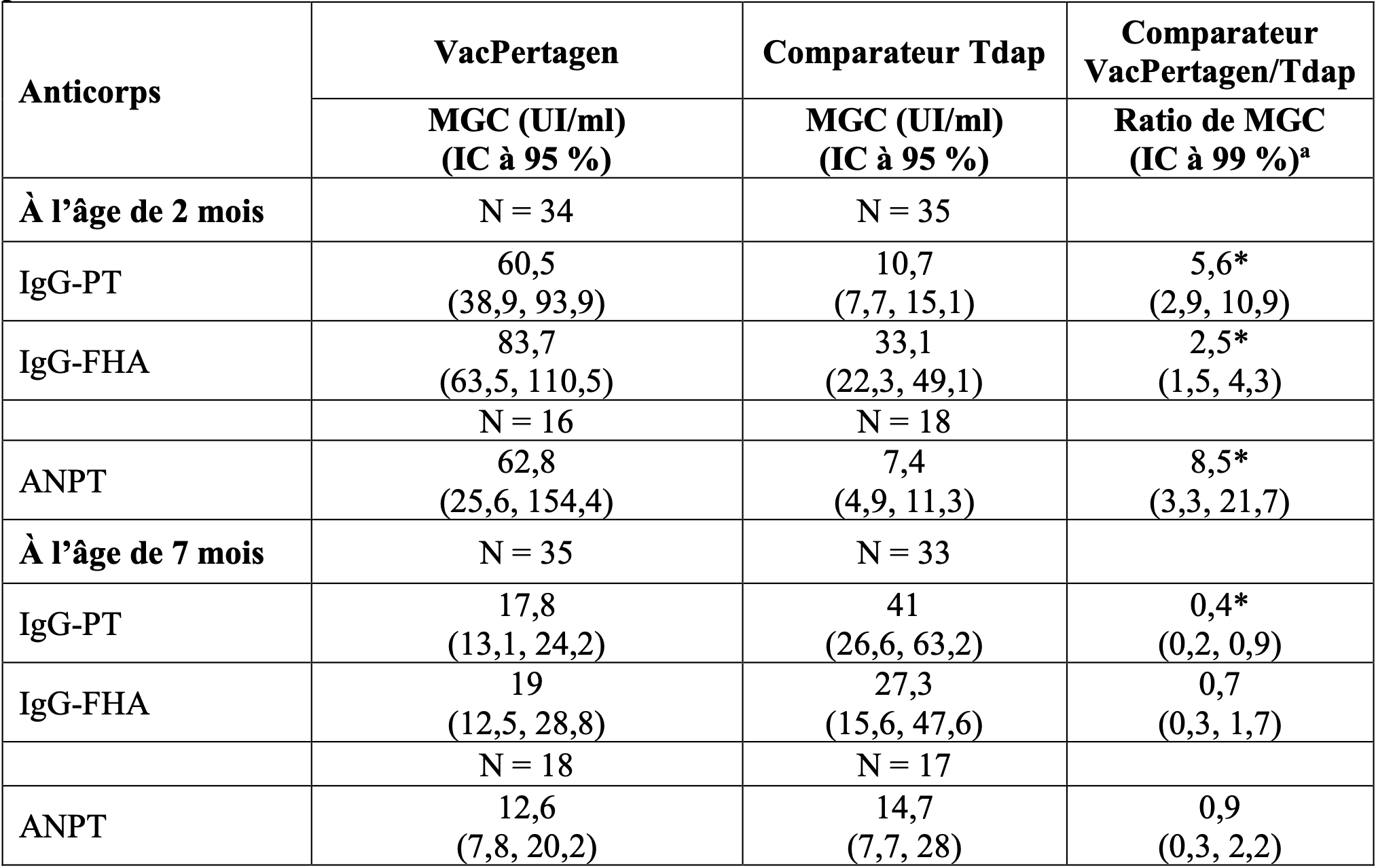
* Différence significative avec une valeur p < 0,05.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’essais réalisés avec VacPertagen dans tous les sous-groupes de la population pédiatrique pour la prévention de la coqueluche. Voir la rubrique "Posologie" pour les informations relatives à utilisation pédiatrique.
Conservation
Durée de conservation : 5 ans.
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
À conserver dans l’emballage d’origine à l’abri de la lumière.
Le vaccin non ouvert est stable pendant 3 jours au total lorsqu’il est conservé à des températures comprises entre 8 °C et 25 °C. À la fin de cette période, VacPertagen doit être utilisé ou éliminé. Ces données sont uniquement destinées à guider les professionnels de santé en cas d’excursion temporaire de la température.
En l’absence d’études de compatibilité, ce vaccin ne doit pas être mélangé avec d’autres médicaments.
Manipulation
Tout médicament non utilisé ou tout déchet doit être éliminé conformément à la réglementation en vigueur.
Autres informations
Toxicité générale
Les études classiques de toxicité à dose unique et à doses répétées chez le rat n’ont révélé aucun risque particulier pour l’homme.
Génotoxicité/cancérogénicité
Aucune étude de génotoxicité ni de cancérogénicité n’a été réalisée. Les composants du vaccin ne sont pas censés présenter un potentiel génotoxique.
Toxicité pour la reproduction et le développement
Deux études de toxicité pour le développement prénatal et postnatal de Td-VacPertagen ne révèlent aucun effet de toxicité sur la grossesse maternelle, la parturition, l’allaitement, le développement embryo-fœtal et les performances reproductives chez le rat.
Le vaccin VACPERTAGEN est fabriqué par le laboratoire BioNet-Asia sur son site GMP d’Ayutthaya (Thaïlande).
La société BioNet Europe est en charge de sa responsabilité réglementaire en Europe.
Pas encore de recommandation vaccinale en France (en attente d'un avis de la Haute Autorité de santé).
Ce vaccin présente plusieurs avantages : il évite de survacciner inutilement contre d'autres maladies et pourrait réduire, en cas de vaccination maternelle, le phénomène de “blunting” pour les valences diphtérique, tétanique ou poliomyélitique.